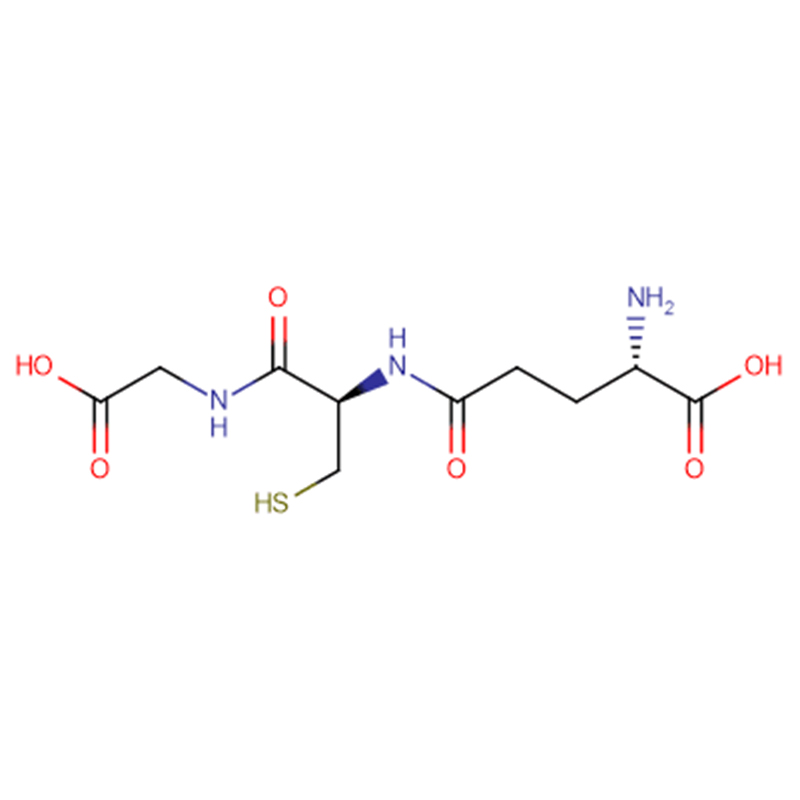
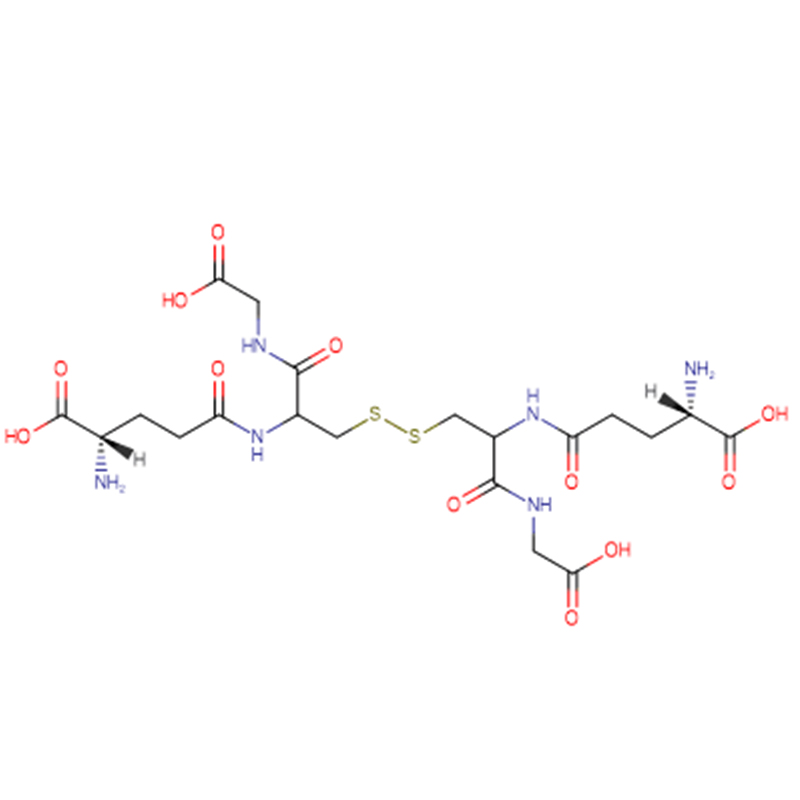
GSH Cas: 70-18-8 98% wit kristallijn poeder
| Catalogus nummer | XD90227 |
| productnaam | GSH |
| CAS | 70-18-8 |
| Moleculaire formule | C10H17N3O6S |
| Molecuulgewicht | 307.323 |
| Opslaggegevens | 2 tot 8 °C |
| Geharmoniseerde Tarievencode | 29309098 |
Productspecificatie
| Productspecificatie | |
| Smeltpunt | 185°C |
| Cijfer | Pharma-kwaliteit |
| Zware metalen | maximaal 10 p.p.m |
| Arseen | maximaal 2ppm |
| Identificatie | IR: vergelijkbaar met het referentiespectrum |
| Verlies bij drogen | Maximaal 0,5% |
| Bewaar temperatuur | +20°C |
| Molecuulgewicht | 612,63 |
| Test | min. 98,0% |
| Optische rotatie | -15,5°- -17,5 gr |
| Residu op ontsteking | Maximaal 0,1% |
| Duidelijkheid van oplossing | Helder en kleurloos |
| Verschijning | Wit kristallijn poeder |
| Gerelateerde stof | Totaal: maximaal 2,0%, GSSG: maximaal 1,5% |
Het ORF45-eiwit van Kaposi's sarcoom-geassocieerd herpesvirus (KSHV) is een gammaherpesvirus-specifiek direct-early tegument-eiwit.Onze eerdere studies hebben zijn cruciale rol in zowel vroege als late stadia van KSHV-infectie onthuld.In deze studie hebben we het interactoom van ORF45 onderzocht met behulp van een panel van monoklonale antilichamen.Naast de eerder geïdentificeerde extracellulaire gereguleerde kinase (ERK) en p90 ribosomale S6 kinase (RSK) eiwitten, vonden we verschillende andere co-gezuiverde eiwitten, waaronder prominente eiwitten van ∼38 kDa en ∼130 kDa.Massaspectrometrie onthulde dat het eiwit van 38 kDa viraal ORF33 is en het eiwit van 130 kDa cellulair USP7 (ubiquitine-specifiek protease 7).We brachten het ORF33-bindende domein in kaart op de sterk geconserveerde carboxyl-terminale 19 aminozuren (aa) van ORF45 en het USP7-bindende domein op het gerapporteerde consensusmotief in het centrale gebied van ORF45.Met behulp van immunofluorescentiekleuring hebben we colokalisatie van ORF45 met ORF33 of USP7 waargenomen, zowel onder getransfecteerde omstandigheden als in met KSHV geïnfecteerde cellen.Bovendien merkten we ORF45-afhankelijke herlokalisatie op van een deel van ORF33/USP7 van de kern naar het cytoplasma.We ontdekten dat ORF45 een toename in ORF33-eiwitaccumulatie veroorzaakte die werd opgeheven als het ORF33- of USP7-bindende domein in ORF45 werd verwijderd.Bovendien verminderde deletie van het geconserveerde carboxyluiteinde van ORF45 in het KSHV-genoom drastisch het niveau van ORF33-eiwit in met KSHV geïnfecteerde cellen en maakte een einde aan de productie van nageslachtvirionen.Gezamenlijk onthullen onze resultaten niet alleen nieuwe componenten van het ORF45-interactoom, maar tonen ze ook aan dat de interacties tussen deze eiwitten cruciaal zijn voor de lytische replicatie van KSHV. Kaposi's sarcoom-geassocieerd herpesvirus (KSHV) is de veroorzaker van verschillende menselijke kankers.KSHV ORF45 is een multifunctioneel eiwit dat nodig is voor KSHV lytische replicatie, maar de exacte mechanismen waarmee ORF45 zijn kritieke functies vervult, zijn onduidelijk.Onze eerdere studies hebben aangetoond dat alle ORF45-eiwitten in cellen voorkomen in complexen met een hoog molecuulgewicht.We hebben daarom geprobeerd het interactoom van ORF45 te karakteriseren om inzicht te geven in zijn rollen tijdens lytische replicatie.Met behulp van een panel van monoklonale antilichamen onderzochten we het ORF45-interactoom in met KSHV geïnfecteerde cellen.We identificeerden twee nieuwe bindingspartners van ORF45: het virale eiwit ORF33 en cellulair ubiquitine-specifiek protease 7 (USP7).We tonen verder aan dat de interactie tussen ORF45 en ORF33 cruciaal is voor de efficiënte productie van KSHV-virale deeltjes, wat suggereert dat de gerichte interferentie met deze interactie een nieuwe strategie kan zijn om KSHV-lytische replicatie te remmen.