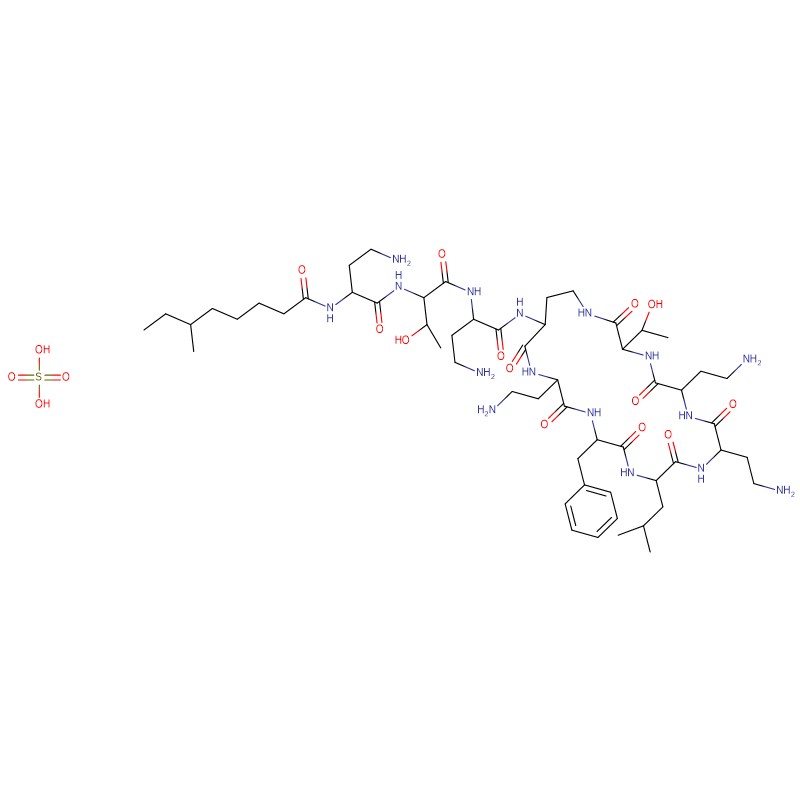
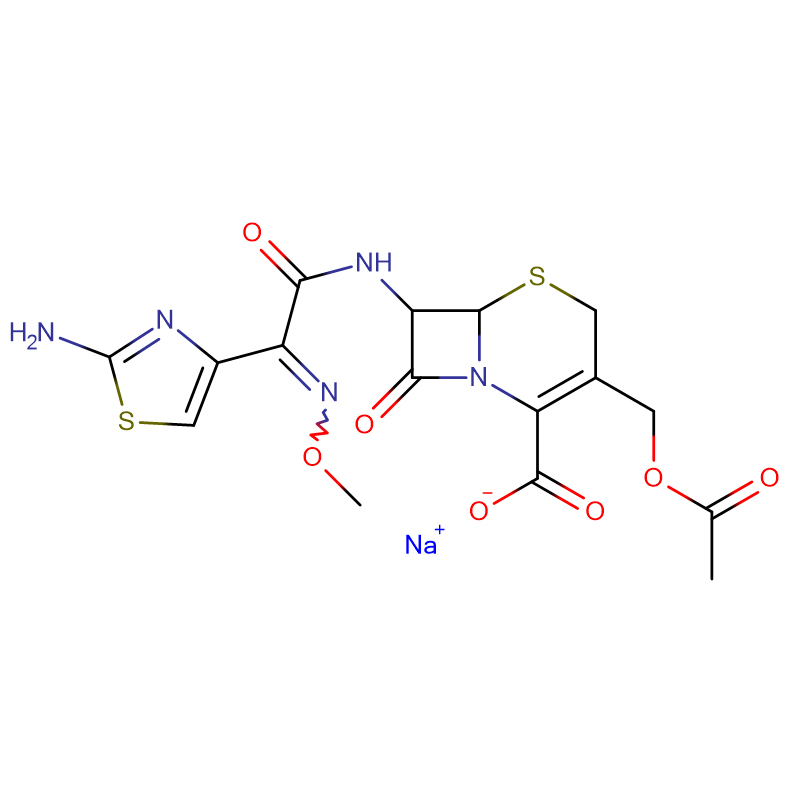
Polymyxine B-sulfaat CAS: 1405-20-5 Wit poeder
| Catalogus nummer | XD90360 |
| productnaam | Polymyxine B-sulfaat |
| CAS | 1405-20-5 |
| Moleculaire formule | C55H96N16O13 · 2H2SO4 |
| Molecuulgewicht | 1385.61 |
| Opslaggegevens | 2 tot 8 °C |
| Geharmoniseerde Tarievencode | 29419000 |
Productspecificatie
| Conclusie | Voldoet aan USP35 |
| Zware metalen | <20ppm |
| pH | 5-7 |
| Identificatie | Vloeistofchromatografie: voldoet |
| Test | 99% |
| Verschijning | wit poeder |
| Verlies bij drogen | <6% |
| Oplosbaarheid | Vrij oplosbaar in water, lichtjes oplosbaar in Ethanol |
| sulfaat | 15,5% - 17,5% |
| Deeltjesgrootte | <30µm |
| Specifieke optische rotatie | -78° -90° |
| Fenylalanine | 9,0%-12,0% |
| pyrogenen | Voldoet aan de eisen |
| As met zwavel | <0,75% |
| Totaal levensvatbaar aeroob aantal | <100kve/g |
| Potentie | >6500 IE/mg |
Het ExPortal-eiwituitscheidingsorganel in Streptococcus pyogenes is een anionisch fosfolipidenbevattend membraanmicrodomein verrijkt met Sec-translocons en postsecretie-eiwitbiogenesefactoren.Polymyxine B bindt zich aan en verstoort de integriteit van ExPortal, wat resulteert in een gebrekkige afscheiding van verschillende toxines.Om inzicht te krijgen in factoren die de ExPortal-organisatie beïnvloeden, werd een genetische screening uitgevoerd om te selecteren op spontane polymyxine B-resistente mutanten die verbeterde ExPortal-integriteit vertoonden.Herschikking van het hele genoom van 25 resistente mutanten onthulde één tot vier mutaties per mutantgenoom, voornamelijk geclusterd binnen een kernset van 10 gengroepen.Constructie van mutanten met individuele deleties of inserties toonde aan dat 7 kerngenen resistentie en verbeterde ExPortal-integriteit verlenen door functieverlies, terwijl 3 waarschijnlijk te wijten waren aan functiewinst en/of combinatorische effecten.Kernresistentiegenen omvatten een transcriptionele regulator van de biosynthese van lipiden, verschillende genen die betrokken zijn bij de verwerving van voedingsstoffen en een verscheidenheid aan genen die betrokken zijn bij stressreacties.Twee leden van de laatstgenoemde klasse fungeren ook als nieuwe regulatoren van het uitgescheiden SpeB-cysteïneprotease.Analyse van de meest frequent geïsoleerde mutatie, een deletie van een enkele nucleotide in een spoor van 9 opeenvolgende adenineresiduen in pstS, die codeert voor een component van een Pi-transporter met hoge affiniteit, suggereert dat deze sequentie functioneert als een moleculaire schakelaar om stressaanpassing te vergemakkelijken.Samen suggereren deze gegevens het bestaan van een membraanstressrespons die verbeterde ExPortal-integriteit en weerstand tegen kationische antimicrobiële peptiden bevordert.