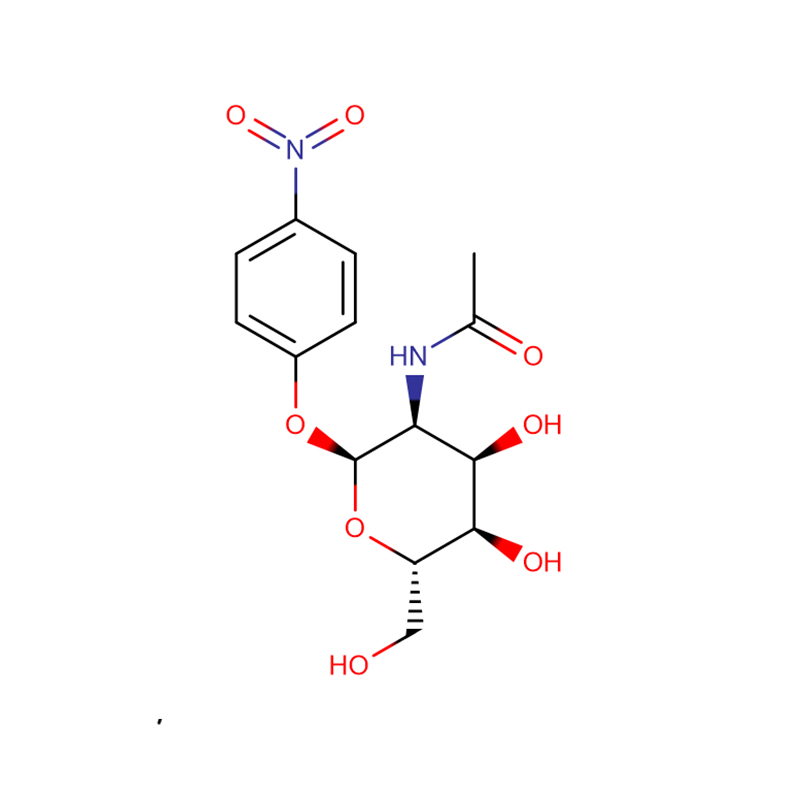
p-nitrofenyl -aL-fucopyranoside Cas:10231-84-2 Wit tot lichtgeel kristallijn poeder
| Catalogus nummer | XD90142 |
| productnaam | p-nitrofenyl-aL-fucopyranoside |
| CAS | 10231-84-2 |
| Moleculaire formule | C12H15NO7 |
| Molecuulgewicht | 285,25 |
| Opslaggegevens | 2 tot 8 °C |
| Geharmoniseerde Tarievencode | 29400000 |
Productspecificatie
| Verschijning | Wit tot lichtgeel kristallijn poeder |
| Assay | 99% |
| TLC | Enkele plek |
| Zuiverheid HPLC | minimaal 98% |
| Oplosbaarheid (1 % in water) | Heldere kleurloze oplossing |
| Dikte | 1.503±0.06 g/cm3 (20 ºC 760 Torr), |
| Smeltpunt | 196-197 ºC |
| Kookpunt | 515,4 ° Cat760 mmHg |
| Vlampunt | 265,5°C |
| Brekingsindex | 1.623 |
LecA (PA-IL) is een cytotoxisch lectine en adhesine geproduceerd door Pseudomonas aeruginosa dat hydrofobe galactosiden bindt met hoge specificiteit en affiniteit.Door een lecA-egfp translatiefusie en immunoblotanalyse van de biofilm extracellulaire matrix te gebruiken, laten we zien dat lecA tot expressie wordt gebracht in in biofilm gekweekte cellen.In statische biofilmtesten op zowel polystyreen als roestvrij staal, werden de biofilmdiepte en oppervlaktedekking verminderd door mutatie van lecA en verbeterd in de LecA-overproducerende stam PAO-P47.Biofilm-oppervlaktebedekking door de ouderstam, PAO-P47 maar niet de lecA-mutant op stalen coupons, werd ook geremd door groei in aanwezigheid van ofwel isopropyl-beta-D-thiogalactoside (IPTG) of p-nitrofenyl-alfa-D-galactoside ( NPG).Bovendien kunnen volwassen wild-type biofilms gevormd in de afwezigheid van deze hydrofobe galactosiden worden gedispergeerd door de toevoeging van IPTG.Daarentegen had toevoeging van p-nitrofenyl-alfa-L-fucose (NPF), dat een hoge affiniteit heeft voor de P. aeruginosa LecB (PA-IIL) lectine, geen effect op biofilmvorming of -verspreiding.Planktonische groei van P. aeruginosa PAO1 werd niet beïnvloed door de aanwezigheid van IPTG, NPG of NPF, noch was de stam in staat om deze suikers als koolstofbronnen te gebruiken, wat suggereert dat de waargenomen effecten op biofilmvorming te wijten waren aan de competitieve remming van LecA-ligand verbindend.Vergelijkbare resultaten werden ook verkregen voor biofilms gekweekt onder dynamische stromingsomstandigheden op stalen coupons, wat suggereert dat LecA bijdraagt aan P. aeruginosa biofilmarchitectuur onder verschillende omgevingsomstandigheden.
In de bladeren van Arabidopsis-planten is een alfa-L-fucosidase (EC 3.2.1.51) gedetecteerd dat in staat is om het t-fucosylresidu uit de zijketen van xyloglucan-oligosacchariden vrij te maken.Bovendien werd een alfa-L-fucosidase met vergelijkbare substraatspecificiteit gezuiverd uit koolbladeren (Brassica oleracea) om een enkele band op SDS-PAGE te maken.Twee peptidesequenties werden verkregen uit deze eiwitband en ze werden gebruikt om een Arabidopsis-gen te identificeren dat codeert voor een alfa-fucosidase dat we voorstellen AtFXG1 te noemen.Bovendien is er ook een Arabidopsis-gen gevonden met homologie met bekende alfa-L-fucosidasen, en we hebben voorgesteld om het te noemen als AtFUC1.Zowel AtFXG1 als ATFUC1 werden heteroloog tot expressie gebracht in Pichia pastoris-cellen en de alfa-L-fucosidase-activiteiten werden uitgescheiden in het kweekmedium.Het alfa-L-fucosidase gecodeerd door AtFXG1 was actief tegen de oligosacchariden van xyloglucan XXFG en ook tegen 2'-fucosyl-lactitol maar niet tegen p-nitrofenyl-alfa-L-fucopyranoside.Het op heterologe wijze tot expressie gebrachte AtFUC1 was echter alleen actief tegen 2'-fucosyl-lactitol.De eerste moet dus verband houden met het metabolisme van xyloglucan.