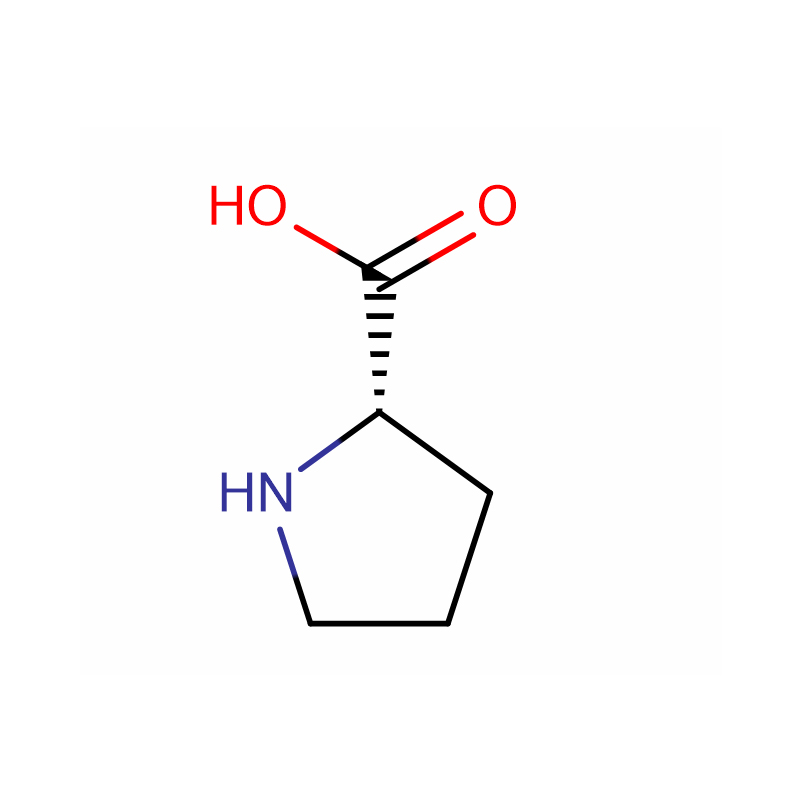
L-Proline Cas: 147-85-3 99% wit poeder
| Catalogus nummer | XD90293 |
| productnaam | L-Proline |
| CAS | 147-85-3 |
| Moleculaire formule | C5H9NO2 |
| Molecuulgewicht | 115.13046 |
| Opslaggegevens | Omgeving |
| Geharmoniseerde Tarievencode | 29339980 |
Productspecificatie
| Test | 99% min |
| Verschijning | wit poeder |
| Specifieke rotatie | -84,5 tot -86 |
| Zware metalen | <15ppm |
| AS | <1ppm |
| Ph | 5,9 - 6,9 |
| SO4 | <0,050% |
| Fe | <30ppm |
| Verlies bij drogen | <0,3% |
| Residu op ontsteking | <0,10% |
| NH4 | <0,02% |
| Cl | <0,050% |
| Staat van oplossing | >98% |
Het begrijpen van het metabolisme van de microbiële gastheer is essentieel voor de ontwikkeling en optimalisatie van biokatalytische processen op basis van hele cellen, aangezien het de productie-efficiëntie dicteert.Dit geldt in het bijzonder voor redox-biokatalyse waarbij metabolisch actieve cellen worden gebruikt vanwege de cofactor/cosubstraat regeneratieve capaciteit die endogeen is in de gastheer.Recombinant Escherichia coli werd gebruikt voor de overproductie van proline-4-hydroxylase (P4H), een dioxygenase dat de hydroxylering van vrij L-proline in trans-4-hydroxy-L-proline met a-ketoglutaraat (a-KG) als cosubstraat katalyseert.In deze biokatalysator met hele cellen levert het centrale koolstofmetabolisme het vereiste co-substraat a-KG, waardoor de biokatalytische prestaties van P4H rechtstreeks worden gekoppeld aan het koolstofmetabolisme en de metabole activiteit.Door zowel experimentele als computationele biologische hulpmiddelen toe te passen, zoals metabolische engineering en (13)C-metabolische fluxanalyse ((13)C-MFA), hebben we de fysiologische, metabolische en bio-energetische respons van de biokatalysator van de hele cel onderzocht en kwantitatief beschreven. naar de gerichte bioconversie en identificeerde mogelijke metabole knelpunten voor verdere rationele route-engineering. Een proline-degradatie-deficiënte E. coli-stam werd geconstrueerd door het putA-gen dat codeert voor proline dehydrogenase te verwijderen.Biotransformaties van hele cellen met deze mutante stam leidden niet alleen tot kwantitatieve prolinehydroxylering, maar ook tot een verdubbeling van de specifieke vormingssnelheid van trans-4-L-hydroxyproline (hyp), in vergelijking met het wildtype.Analyse van koolstofflux door centraal metabolisme van de gemuteerde stam onthulde dat de verhoogde a-KG-vraag naar P4H-activiteit de a-KG-genererende flux niet verhoogde, wat wijst op een strak gereguleerde werking van de TCA-cyclus onder de bestudeerde omstandigheden.In de wildtype stam veroorzaakten P4H-synthese en katalyse een vermindering van de biomassa-opbrengst.Interessant is dat de ΔputA-stam bovendien het bijbehorende ATP- en NADH-verlies compenseerde door de onderhoudsbehoefte aan energie te verminderen bij vergelijkbaar lage glucoseopnamesnelheden, in plaats van de TCA-activiteit te verhogen. veelbelovend zijn voor productieve P4H-katalyse, niet alleen in termen van biotransformatie-opbrengst, maar ook met betrekking tot de snelheden voor biotransformatie en proline-opname en de opbrengst van hyp op de energiebron.De resultaten geven aan dat, na een putA-knock-out, de koppeling van de TCA-cyclus aan proline-hydroxylering via het co-substraat a-KG een sleutelfactor wordt en een doel wordt om de efficiëntie van a-KG-afhankelijke biotransformaties verder te verbeteren.