D-glutaminezuur CAS:6893-26-1 99% Wit poeder
| Catalogus nummer | XD90313 |
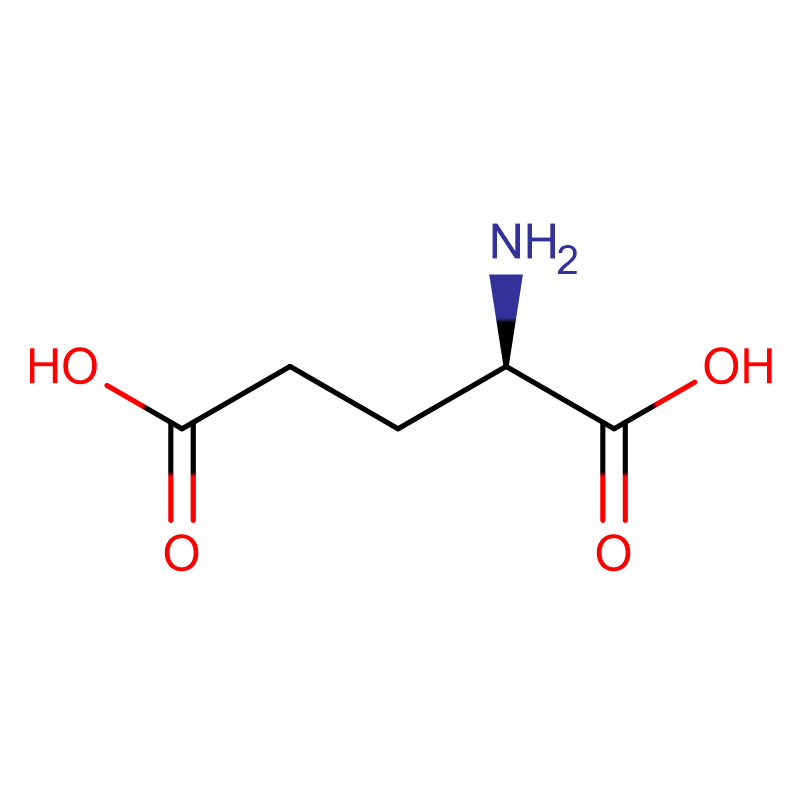
| productnaam | D-Glutaminezuur |
| CAS | 6893-26-1 |
| Moleculaire formule | C5H9NO4 |
| Molecuulgewicht | 147.13 |
| Opslaggegevens | Omgeving |
| Geharmoniseerde Tarievencode | 29224200 |
Productspecificatie
| Verschijning | Wit kristallijn poeder |
| Test | 99% |
| Specifieke rotatie | -31 tot -32,2 |
| Zware metalen | <10ppm |
| AS | <1ppm |
| pH | 3 - 3,5 |
| SO4 | <0,020% |
| Fe | <10ppm |
| Verlies bij drogen | <0,20% |
| Residu op ontsteking | <0,10% |
| NH4 | <0,02% |
| Cl | <0,02% |
| Staat van oplossing | >98% |
γ-glutamyltranspeptidasen (γ-GT's) splitsen de γ-glutamylamidebinding van glutathion en brengen de vrijgekomen γ-glutamylgroep over in water (hydrolyse) of acceptoraminozuren (transpeptidatie).Deze alomtegenwoordige enzymen spelen een sleutelrol in de biosynthese en afbraak van glutathion, en in xenobiotische ontgifting.Hier rapporteren we de kristalstructuur met een resolutie van 3 A van Bacillus licheniformis γ-GT (BlGT) en die van zijn complex met l-Glu.Röntgenstructuren bevestigen dat BlGT tot de N-terminale nucleofiele hydrolase-superfamilie behoort en onthullen dat het eiwit een geopende actieve site-spleet heeft die lijkt op die gerapporteerd voor het homologe enzym van Bacillus subtilis, maar verschilt van die waargenomen voor menselijk γ-GT en voor γ-GT's van andere micro-organismen.Gegevens suggereren dat de binding van l-Glu een herordening van de C-terminale staart van de grote BlGT-subeenheid induceert en de identificatie mogelijk maakt van een cluster van zuurresiduen die mogelijk betrokken zijn bij de herkenning van een metaalion.De rol van deze residuen op de conformationele stabiliteit van BlGT is bestudeerd door de autoprocessing, enzymatische activiteit, chemische en thermische denaturatie van vier nieuwe Ala enkele mutanten te karakteriseren.De resultaten laten zien dat vervanging van Asp568 door een Ala zowel de autoprocessing als de structurele stabiliteit van het eiwit beïnvloedt.